Електроліз та електроліти#
Електролітична дисоціація - це процес розпаду речовин на іони внаслідок дії полярних молекул розчинника.
Спостерігати це явище можна, коли кристалик кухонної солі потрапляє у воду: полярні молекули води оточують іони Натрію та іони Хлору й відокремлюють їх від кристалика. У результаті цього процесу у воді з'являються вільні носії заряду (позитивні й негативні іони).
Природа струму в електролітах#
Електроліти — тверді або рідкі речовини, які мають іонну провідність.
Оскільки механізм провідності у твердих електролітах доволі складний, ми зосередимося на рідких електролітах.
Коли солі, кислоти чи луги розчиняються, вони часто розпадаються на позитивно та негативно заряджені іони (явище електролітичної дисоціації). Такі розчини і є електролітами. Варто зазначити, що деякі речовини стають електролітами не лише в розчинах, але й при сильному нагріванні - їхні розплави також проводять струм.
Без зовнішнього електричного поля іони рухаються хаотично. Проте варто помістити в електроліт електроди, підключені до джерела струму, як картина кардинально змінюється:
Позитивні іони (катіони) притягуються до негативного електрода (катода)
Негативні іони (аніони) прямують до позитивного електрода (анода)
Цей впорядкований рух заряджених частинок в електроліті і створює електричний струм в електролітах.
Цікаво, що на відміну від металів, опір електролітів зменшується з підвищенням температури. Це пояснюється тим, що при нагріванні збільшується кількість іонів у розчині (деякі речовини не дисоціюють на іони повністю, однак при підвищенні температури, вони починають дисоціювати активніше і в розчин виділяється більша кількість позитивних та негативних іонів, що стають частиною електричного струму в електролітах).
Сутність електролізу#
При проходженні струму через електроліт відбуваються не лише переміщення йонів, але й хімічні перетворення на електродах.
Візьмемо, наприклад, розчин купрум(II) хлориду (CuCl₂). Під дією електричного поля:
іони Cu²⁺ рухаються до катода, де захоплюють електрони і перетворюються на атоми міді, які осідають на поверхні
іони Cl⁻ прямують до анода, де віддають свої електрони і перетворюються на молекули хлору, які виділяються як газ
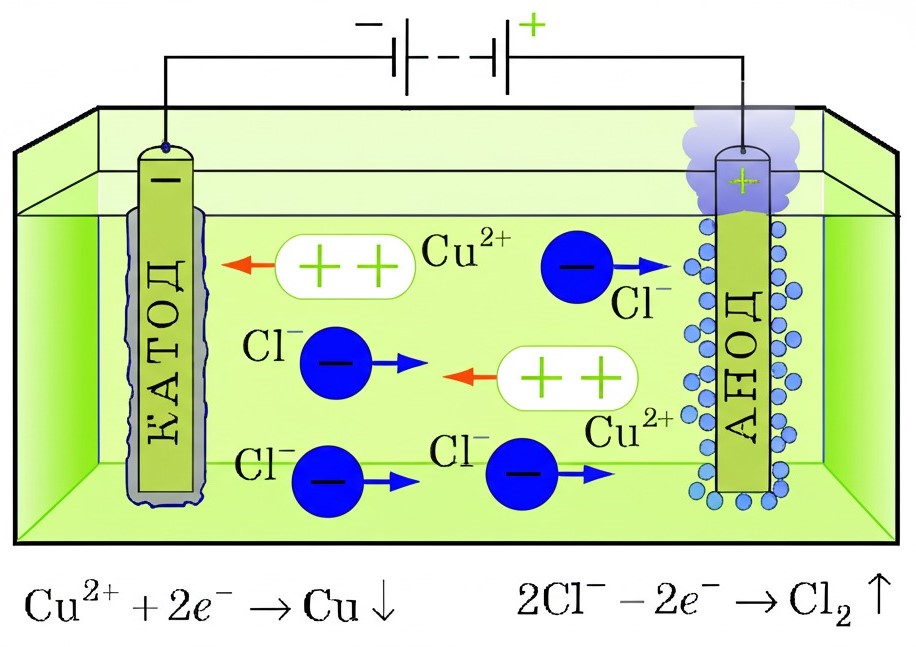
Рис. 1. Приклад електролізу із відповідними хімічними реакціями. Сіль \(\text{CuCl}_2\) дисоціює і розкладається на окремі іони. Потім ці іони переміщуються в електроліті під дією електричного поля створеного катодом та анодом. Як результат віддачі електронів чи, навпаки, отримання електронів, відбувається хімічна реакція з утворенням осаду (мідний осад на катоді) та виділенням газу (хлор виділяється біля аноду)
На катоді відбувається реакція відновлення (приєднання електронів), а на аноді – реакція окиснення (втрата електронів).
Таким чином, електролізом називають процес виділення речовин на електродах внаслідок окисно-відновних реакцій, спричинених проходженням електричного струму через розчин або розплав електроліту.
Закони Фарадея#
Фундаментальні закономірності електролізу відкрив британський вчений Майкл Фарадей у 1830-х роках. Шляхом ретельних експериментів він встановив два важливі закони:
Перший закон електролізу#
Маса речовини, що виділяється на електроді, прямо пропорційна силі струму та часу його проходження через електроліт:
де:
\(m\) – маса виділеної речовини
\(I\) – сила струму
\(t\) – час проходження струму
\(q\) – електричний заряд, що пройшов через електроліт
\(k\) – електрохімічний еквівалент речовини (константа для кожної речовини)
Другий закон електролізу#
Електрохімічний еквівалент речовини залежить від її хімічних властивостей:
де:
\(M\) – молярна маса речовини (вимірюється в кг/моль)
\(n\) – валентність елемента в сполуці (безрозмірна величина)
\(F\) – стала Фарадея (\(9.65 \cdot 10^4\) Кл/моль) – модуль заряду одного моля електронів, тобто \(F = |e|N_A\)
Ці закони дозволяють точно розрахувати масу речовини, яка виділиться під час електролізу.
Практичне застосування електролізу#
Електроліз знайшов численні застосування в сучасних технологіях:
Гальванотехніка
Гальваностегія – нанесення тонких захисних або декоративних металевих покриттів (хромування, сріблення, позолочення)
Гальванопластика – виготовлення точних металевих копій рельєфних виробів (наприклад, для створення друкарських форм)
Металургія
Виробництво металів – отримання чистих металів з їхніх солей або оксидів
Рафінування – очищення металів від домішок (особливо важливе для міді, необхідної в електротехніці)
Енергетика та екологія
Виробництво водню – розщеплення води на водень (на катоді) та кисень (на аноді)
Зарядження акумуляторів – відновлення хімічних елементів батареї
Очищення стічних вод – видалення важких металів та розкладання органічних забруднювачів
У свинцевих акумуляторах при розрядці на обох електродах утворюється PbSO₄, а при зарядці завдяки електролізу:
На катоді відновлюється металевий свинець
На аноді утворюється PbO₂
Концентрація сірчаної кислоти в розчині зростає
Таким чином, електроліз – це не лише цікаве фізико-хімічне явище, але й надзвичайно важливий технологічний процес у багатьох галузях промисловості та техніки.

